
第88期
出刊日:2019-10-15
返回上一層封面故事/肝癌如何「除惡務盡」?
台灣肝病病人雖然多,但是肝癌病人的治療成效也是國際上數一數二的優質!
頂尖雜誌《Nature Reviews Gastroenterology & Hepatology》於2019年8月22日刊登文章指出,台灣和日本是肝癌病人存活最長的國家,與國家實施嚴密篩檢、肝癌能早期發現有關。
頂尖雜誌《Nature Reviews Gastroenterology & Hepatology》於2019年8月22日刊登文章指出,台灣和日本是肝癌病人存活最長的國家,與國家實施嚴密篩檢、肝癌能早期發現有關。
雖然肝癌仍居國人十大癌症死因第二位,但治療的方法也愈來愈多,只要定期追蹤、早期發現,戰勝肝癌不是夢!
諮詢╱梁嘉德(臺大醫院內科部主治醫師、臺大醫學院內科臨床助理教授)
撰稿╱黃筱珮
在2004年以前,肝癌長期蟬聯台灣癌症死因之首,儘管之後被肺癌超越,多年來仍高居癌症死亡率第二位。根據衛福部最新統計資料,台灣每年有超過1萬1千人診斷出肝癌,每年8千多人死於肝癌,不論對個人健康或家庭經濟均帶來嚴重衝擊。
找出肝癌更有效的治療突破,追求「除惡務盡」,一直是醫學界努力的方向,所幸,隨著醫學不斷進步,如今在肝癌治療領域中,已有較以往更多的篩檢技術及治療選擇,面對這個無聲的奪命癌症,不再節節敗退、束手無策。
肝癌的危險因子
台灣的肝癌大部分是肝細胞癌,85%以上是和慢性病毒性肝炎感染有關,亦即慢性B型肝炎與慢性C型肝炎。慢性病毒性肝炎會造成肝硬化,進而產生肝癌。
除了慢性B、C型肝炎病毒感染以外,其它包括:肝硬化、酒精、黃麴毒素、自體免疫性肝炎、寄生蟲感染、代謝性疾病(鐵沈著症、威爾遜氏症「銅代謝異常」)、原發性膽道肝硬化及其他少數肝臟浸潤性疾病等、亦或家族中曾有人罹患肝癌,或長期飲用含砷井水,都屬於肝癌的危險因子。
國家衛生研究院近年來的研究也發現,「脂肪肝」、「糖尿病」及「三酸甘油酯過高」是除了病毒性肝炎以外的致癌3大危險因子,且癌化過程不一定會有肝硬化,隨著生活型態西化,國人脂肪肝和代謝症候群的患者數持續增加,可預期無慢性病毒肝炎感染的肝癌患者比例將會持續攀升。
肝癌分期
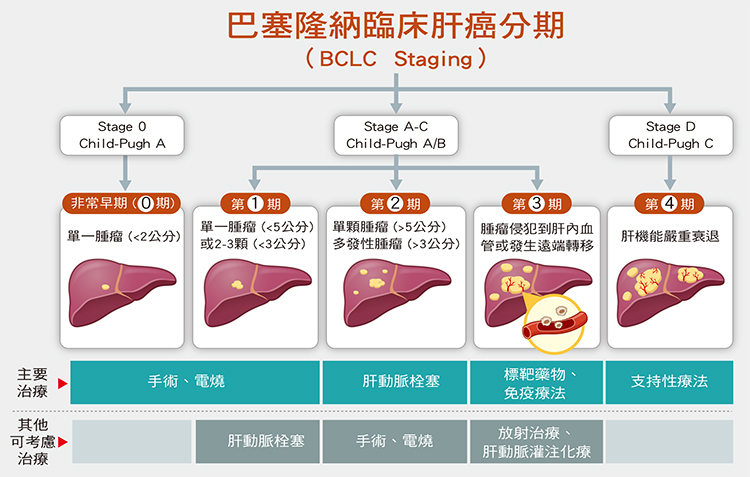
肝癌的分期,較常使用為巴塞隆納臨床肝癌分期,依據病人本身肝臟功能、腫瘤大小、腫瘤數目,以及腫瘤是否影響到肝臟血管及轉移等情況,大致分為0~4期。
第0期
如果患者肝腫瘤為單一顆、小於2公分,可歸納為第0期,患者的預後、存活率最好。
第1期
腫瘤少於或等於3顆、每顆皆小於3公分;或單顆小於5公分,屬於第1期。第1期病人預後很好,可盡量採手術或射頻燒灼術治療,達到完全清除腫瘤。另一個選擇治療方式為進行肝臟移植。
第2期
當單顆腫瘤體積超過5公分,或是多發性腫瘤,大小超過3公分,歸納為第2期。此時能夠以手術或電燒完全清除腫瘤的難度提高,無法開刀或電燒者,會建議經肝動脈血管栓塞治療,或再加上合併其它治療,多種治療齊下控制腫瘤生長。
第3期
當腫瘤侵犯到肝內血管或發生遠端轉移,即為肝癌第3期。肝癌的分期與其它腫瘤分期不同,其它癌症若發生轉移都屬第4期,在肝癌屬3期。當腫瘤位置已散發、不侷限於肝臟內,則治療必須進行標靶藥物治療或免疫治療等全身性治療。
第4期
不論腫瘤大小、幾顆、是否轉移,只要患者的肝臟功能差,肝機能嚴重衰退,皆屬於第4期,此期治療棘手,預後多半不好、存活率低。
抽血及影像檢查可確診肝癌
肝癌診斷可經由血液檢查、影像檢查和病理組織三方面確診,其中,抽血檢驗血清中的「胎兒蛋白」(AFP)可以作為肝癌的腫瘤標記。因有高風險因子而需定期追蹤的病人,若胎兒蛋白超過標準,就要注意是否有肝癌,不過由於肝臟發炎、細胞再生或懷孕時,或有泌尿生殖系統疾病,AFP數值也可能升高,因此要再配合影像檢查才能作出準確的判斷。
影像檢查包括超音波掃描、電腦斷層、血管攝影、磁振造影檢查等,對於肝癌的診斷具有參考價值,也能彌補血液檢查的不足。若是影像檢查仍無法完全確定,可考慮肝腫瘤切片進行病理檢查,做最後確認。
肝切片即肝穿刺,是在超音波或電腦斷層引導下,用細針直接刺入病人的肝臟,採取些微肝臟組織做檢驗。但如果病人有腹水,或凝血功能太差、意識不清無法配合,就不適宜做切片檢查。
浸潤型肝癌常數不清幾顆腫瘤
一般而言,經由上述檢查可確認是否罹患肝癌、並進行分期,但也有「期別難明」的狀況。大部分的肝腫瘤在影像檢查下「粒粒分明」,獨立生長,但若是「浸潤性肝癌」,多半不成形、邊界也不明,甚至會分散一片,且惡性度通常較大,這時醫師也無法數清究竟有幾顆腫瘤。
針對「浸潤性肝癌」的治療方式,如果發現時腫瘤範圍分布小,會盡量採手術切除乾淨,不過因為浸潤性肝癌惡性高、生長快,發現時多半已有血管浸潤侵犯,此時就需要全身性治療,例如標靶治療。
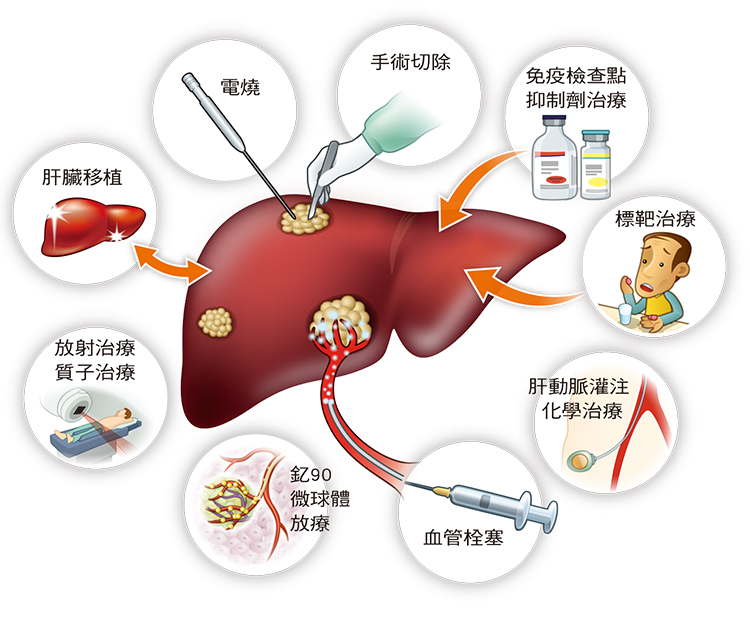
肝癌治療方式
肝癌治療的方式很多,除手術外,另有其他侵襲性較低的治療,如電燒療法(無線射頻燒灼術、微波凝固療法)、經動脈血管栓塞療法、放射治療、標靶治療、免疫療法等多種方式。
其中,手術及電燒屬於「根除性療法」,也就是最能將肝癌除惡務盡的方法,但不是每個病人都能做,且因肝癌具有復發率高的特性,醫師依照病人身體及腫瘤狀況,會選擇最適合的治療,且可能採取不只一種治療。分別介紹如下:
手術切除
手術切除是肝癌治療的第一優先選擇,能達到最好的清除效果,手術方式有3大類:
- 傳統開腹手術:在腹部切開10至20公分的傷口,直接將腫瘤切除,這種術式的視野最好,可以把病灶看得一清二楚,缺點是傷口大,復原慢,病人術後疼痛感受也最強。
- 腹腔鏡手術:通常在腹部開3至4個0.5至1公分的小傷口,用內視鏡由小洞口進入腹腔,將肝臟腫瘤切除。如果肝癌不大,長在肝臟表面,而且侷限於肝臟某一區域範圍,可以考慮用腹腔鏡手術切除,傷口較傳統手術要小,且復原快。
- 達文西機器手臂手術:機器手臂比外科醫師的手更精密、更靈巧,有些角度人手無法執行,機器手臂則無此限制,且機器手臂術式較不會有術後沾黏的問題,傷口小,復原快,惟健保並不給付,要自費20萬元左右。
手術是肝癌治療的優先選擇,不過要看腫瘤大小、數目與生長位置而定。如果肝癌集中在肝臟的其中一葉,就算腫瘤數目多或是長得大,只要能夠切除乾淨,剩餘肝臟也足以負荷恢復期的生理所需,就建議手術;如果多發性腫瘤擴散於肝臟的雙葉,較難切除乾淨,就需考慮其他治療方法。
另外,能否手術治療也要看患者的身體狀況而定,若是年長者、肝臟或心肺功能較差者,建議採電燒方式,減少身體及肝臟的負擔。

《圖說:電燒時將治療針從皮膚穿刺入肝臟腫瘤處,接上電流,以熱能殺死癌細胞。》
腫瘤消融術式
腫瘤消融術式屬於局部治療,依據產生熱能的方式不同,又分為微波凝固療法(MCT)和無線射頻燒灼術(RFA)兩種。無線射頻燒灼術與微波凝固療法皆利用治療針置入腫瘤當中,運用電流以無線射頻或微波方式產生組織震動與熱能,讓癌細胞的蛋白質凝結,達到癌細胞壞死目的。
腫瘤消融術式屬於局部治療,依據產生熱能的方式不同,又分為微波凝固療法(MCT)和無線射頻燒灼術(RFA)兩種。無線射頻燒灼術與微波凝固療法皆利用治療針置入腫瘤當中,運用電流以無線射頻或微波方式產生組織震動與熱能,讓癌細胞的蛋白質凝結,達到癌細胞壞死目的。
- 微波凝固療法:利用微波使分子產生熱能,清除癌細胞,每次燒灼的範圍相對較小、速度較快,適合3公分以下的腫瘤。
- 無線射頻燒灼術:將高頻電流導入腫瘤組織,使分子震動摩擦產生熱能。可燒灼的範圍相對較大,可使用在3至5公分的腫瘤上,但治療時間較長,每次約20至60 分鐘不等。
以電燒療法治療小型肝癌,腫瘤清除率高達9成以上;但若用來治療較大型的肝癌,效果會因腫瘤越大,而逐漸降低腫瘤完整清除率。整體來說,電燒腫瘤消融療法對於早期肝癌的腫瘤清除率與手術治療接近,局部的復發率較手術切除略高,不過病人追蹤長期存活率則無差別。
很多病人怕開刀、擔心傷口大、術後復原慢,特別是年長者、心肺功能差的手術高風險族群,建議選擇電燒療法,傷口只有筆尖大小,術後感染、出血風險以及術後疼痛程度都比開刀低。
經肝動脈血管化學栓塞治療(TACE)
TACE是常用的局部腫瘤治療方法,經由血管攝影確認供應肝癌血流之肝動脈,經由此血管將化學治療藥物直接送到肝癌細胞,達到毒殺腫瘤的效果;同時阻斷此動脈對肝癌細胞的營養供給,將癌細胞「餓死」。適用於多發性腫瘤,或是無法接受切除手術或是電燒等局部治療的病人。
正常肝臟的血流及養分供應,75%來自肝門靜脈,肝動脈來的血流僅佔25%,但肝癌血流供應大部分經由肝動脈。因此經由肝動脈將化學治療藥物與栓塞物質栓塞住供應腫瘤的血管,可將帶入的化療藥劑侷限在被栓塞處,達到治療效果。另外,新一代的載藥微球體(microsphere),則是將化學治療藥物包在載藥微球內,於栓塞到肝腫瘤後,藥物持續緩慢釋出,來達到持續性的治療效果,也可減緩相關的化療藥物與傳統栓塞治療的副作用。
由於血管攝影技術與醫療器械的進步,栓塞療法的安全性已大幅提高,如果治療前經過審慎評估,事後出現消化道出血、膽囊炎、肝膿瘍、肝衰竭等併發症的比例很低。
選擇性體內放射療法(SIRT)
SIRT也是一種肝動脈灌流治療,把含有放射物質釔90微球體經由供應腫瘤血流之肝動脈注入肝腫瘤內,產生局部輻射,以滅殺肝癌。由於從體內輻射直接作用於腫瘤,患者接受的輻射劑量可能較高,且較不會影響周圍器官。SIRT於2002年通過美國FDA核准使用於大腸直腸癌的肝轉移,並於2003年通過歐盟核准使用於無法手術切除的肝腫瘤病患,為晚期肝癌或是大腸直腸癌等其他癌症轉移到肝臟的患者,帶來一線曙光。
放射治療
傳統放射治療會殺滅較大範圍的正常組織,效果較差,副作用也較大。近年來,各種改良式的放射治療,如光子刀、電腦刀及質子刀等,配合使用直線加速器,使高單位能量的輻射線可以更精準照射到腫瘤部位,盡量減少正常細胞受到輻射線的傷害,達到治療效果。當肝腫瘤長進血管、或轉移至淋巴,不容易手術或其它方法治療,可以考慮採取放射治療。
標靶治療
肝癌的標靶治療主要是針對中、晚期的肝癌患者,如果肝功能良好,但因腫瘤已經侵犯肝門靜脈,或是已有肝臟外轉移無法開刀切除,甚至連血管栓塞也不適合者或治療效果不好者,可考慮使用標靶治療。
目前肝癌的標靶藥物有一線藥物蕾莎瓦(商品名Nexavar,學名Sorafenib)、樂衛瑪(商品名Lenvima,學名Lenvatinib),以及二線藥物癌瑞格(商品名Stivarga,學名Regorafenib)。根據歐美或亞太地區研究顯示,使用蕾莎瓦平均存活期相較於不治療者可延長2到3個月,腫瘤縮小的比率為5%,約有30%至40%的患者治療後能保持病情穩定3到6個月,對晚期肝癌病人來說已是一大突破。與蕾莎瓦比較,樂衛瑪平均總生存期雖無明顯差異,但平均無進展生存期與總緩解率皆高於蕾莎瓦。
若蕾莎瓦治療失敗後,接續使用第二線標靶藥癌瑞格的肝癌病人,相較於未使用癌瑞格治療者,病患中位存活期可多延長3個月、降低死亡風險38%、腫瘤縮小比率則約10%。
免疫療法
免疫療法是藉由活化體內免疫細胞,達到清除癌細胞的效果,不論在肝癌治療領域或其它癌症,都如火如荼進行研究中。免疫治療藥物保疾伏(商品名Opdivo,學名Nivolumab)、吉舒達(商品名Keytruda,學名Pembrolizumab)也已經台灣FDA通過作為肝癌第二線全身性治療的選擇,而其他免疫療法藥物或合併療法對肝癌的療效則有待更多臨床試驗確認。
不管是局部性治療、全身性治療,儘管肝癌治療方式已相當多元,醫界對付肝癌有更多武器,但治療效果、預後仍跟診斷早晚最相關。所以務必養成定期追蹤檢查的習慣,特別是B、C肝炎帶原者、慢性肝病、有肝癌家族史的民眾,更不能輕忽,早期發現才是最好的治療對策!
疑惑解除補給站
Q:我有一顆2公分肝癌,選擇電燒治療,兩年後又復發了,若當年選擇開刀是否比較不會復發?
A:不一定,手術與電燒治療的腫瘤清除率相當,特別是小於3公分腫瘤,局部復發率的差異僅1~3%,電燒只略高一些,幾無差別。病人聽從醫師建議選擇最適合的治療方式,配合術後追蹤,調整生活作息,才是與肝癌長期抗戰、降低復發率的基本功。
A:不一定,手術與電燒治療的腫瘤清除率相當,特別是小於3公分腫瘤,局部復發率的差異僅1~3%,電燒只略高一些,幾無差別。病人聽從醫師建議選擇最適合的治療方式,配合術後追蹤,調整生活作息,才是與肝癌長期抗戰、降低復發率的基本功。
Q:如何知道肝癌有沒有清乾淨?
A:病人接受治療後,醫師都會評估及確認療效,例如電燒治療後1個月左右,會為病人安排CT(電腦斷層)或MRI(磁振造影)等檢查,確認腫瘤是否清除乾淨。
A:病人接受治療後,醫師都會評估及確認療效,例如電燒治療後1個月左右,會為病人安排CT(電腦斷層)或MRI(磁振造影)等檢查,確認腫瘤是否清除乾淨。
Q:擔心肝癌復發,除了定期追蹤外,還可以做什麼?
A:若有肝癌相關的危險因子,例如若有B、C肝,病人應該接受治療,以減少癌症再復發的機率。其他就是調整生活習慣、注重均衡營養、規律運動、正常作息,讓肝臟維持最佳的狀態。2019年2月起,B肝引起的肝癌經根除療法後,只要血中B肝病毒量超過2000國際單位,健保就給付抗B肝病毒藥物。
A:若有肝癌相關的危險因子,例如若有B、C肝,病人應該接受治療,以減少癌症再復發的機率。其他就是調整生活習慣、注重均衡營養、規律運動、正常作息,讓肝臟維持最佳的狀態。2019年2月起,B肝引起的肝癌經根除療法後,只要血中B肝病毒量超過2000國際單位,健保就給付抗B肝病毒藥物。
檢查利器》
腹部對比劑增強超音波,診斷肝癌更清楚!
諮詢╱梁嘉德(臺大醫院內科部主治醫師、臺大醫學院內科臨床助理教授)
撰稿╱黃筱珮
撰稿╱黃筱珮
60歲陳先生是慢性C型肝炎感染者,定期在醫院追蹤。最近他接受超音波檢查發現肝臟有陰影,為求慎重,醫師安排進一步磁振造影(MRI)檢查,但他同時罹患有糖尿病、腎功能差,擔心MRI對比劑(contrast agent)傷害腎臟,因此只能接受不施打對比劑MRI檢查,但卻無法確診是否為肝癌。最後陳先生接受「對比劑增強超音波檢查」,確認為肝癌,並經射頻燒灼術(radiofrequency ablation,RFA)治療後完整清除此肝癌,預後良好。
超音波檢查便利但有侷限
腹部超音波是發現肝臟疾病的利器,也是早期篩檢肝癌的重要工具,原理是由超音波探頭打出高頻率的音波,碰到不同組織界面而產生反彈與散射波,再由探頭偵測回彈音波,藉由界面和探頭的相對位置,探察腹部內的組織結構。
腹部超音波是發現肝臟疾病的利器,也是早期篩檢肝癌的重要工具,原理是由超音波探頭打出高頻率的音波,碰到不同組織界面而產生反彈與散射波,再由探頭偵測回彈音波,藉由界面和探頭的相對位置,探察腹部內的組織結構。
由於超音波具備掃描方便、不具侵襲性的特質,檢查時病人不會有痛苦,除了可以偵測腫瘤大小、位置之外,腫瘤是否侵入血管或膽管,病人有沒有腹水,也都可以看得出來,對於後續治療方式的選擇有重要參考價值。
儘管如此,超音波有其侷限,例如有些疑似病灶的「陰影」區域小,無法直接判別究竟是良性腫瘤或組織增生、或是令人害怕的惡性腫瘤,此時就需要再安排病人進一步掃電腦斷層(CT)或磁振造影(MRI)檢查。
CT及MRI檢查有些族群不適用
CT及MRI影像檢查,雖能提供更為精準的鑑別診斷,但CT有輻射曝露的疑慮,而不論是CT或MRI影像檢查必須使用對比劑,而此類對比劑,多數都經由腎臟代謝,也可能造成腎臟傷害,因此腎功能不佳的族群大半不適用。而超音波所使用的對比劑完全不傷害腎臟,於此類病患使用有較高安全性。
此外,在醫院接受CT或MRI檢查,除非是緊急狀況,否則多半需等候檢查排程,排程的空檔,病人難免胡思亂想、心神不寧,很想趕快知道答案。
因此,能夠快速檢查確診、對比劑不傷腎、副作用小,也沒有輻射線曝露疑慮的「對比劑超音波」檢查技術應運而生,成為新選擇之一。
對比劑增強超音波
肝癌診斷及術後追蹤新利器
對比劑增強超音波(Contrast enhanced ultrasonography,CEUS)檢查在歐美、日本等國家行之有年,為肝癌、肝炎的追蹤檢查利器之一。其原理跟CT、MRI類似,經靜脈注射含有直徑僅2~8微米微小氣泡的對比劑,經過超音波的掃描之後,螢幕上呈現出肝腫瘤的血管影像特徵與動態變化,有助於肝腫瘤的鑑別診斷。
增強顯像功能的「對比劑」是一種可被生物分解材質外殼所包覆的「微氣泡」,具有增強超音波散射信號的作用,由於肝癌是高血管性的癌症,血管豐富顯影強,對比劑進入後,很快顯影、也很快退散,具備「來得快也去得快」的特性。
因此,典型肝癌或其它高血管性腫瘤,在對比劑超音波顯影下呈現「快速先亮後暗」的特殊血流變化,若加上病人腫瘤標記「胎兒蛋白」(AFP)上升、又有慢性肝炎等高風險因素綜合判斷,再配合顯影,幾乎當下就能診斷為肝癌。
新一代對比劑經改良
影像判讀更清楚
對比劑增強超音波技術10多年前就發展出來,不過早期對比劑在肝臟內的滯留時間很短,只有約數分鐘,醫師沒有足夠時間判讀影像,很容易錯失定位與判斷時間,因此運用得不廣。
新一代對比劑微氣泡韌性提高,超音波機器性能也提升,不若以前超音波能量太強,容易造成氣泡破裂破壞的缺點,改用較低能量進行微氣泡震盪,反覆產生回音幫助觀察影像,在肝臟內的滯留時間可長達數十分鐘以上,並可藉由動、靜脈血流相與Kupffer phase(庫佛相)等多相特徵變化,更清楚地分辨良性與惡性腫瘤。
所謂的「庫佛相」,指的是肝臟中特有特殊巨噬細胞Kupffer cell(庫佛氏細胞),這種細胞會把對比劑「吃進去」,使得超音波下的肝臟組織影像變白,而癌細胞中並沒有此細胞,因此不具這種特性,因此顯像為黑,以此對比,達到清楚確認病灶的效果。
為使對比劑增強超音波掃描達到更精準的效果,檢查時也可以採取「分批」注射對比劑的方式,不一次把對比劑打入,而是分次打入,分階段與分各個腫瘤分別觀察,如此可避免漏失掉可疑部位,也可拉長時間完整進行「全肝掃描」,這樣的檢查方式雖然時間較長,不過更精準、避免遺漏。
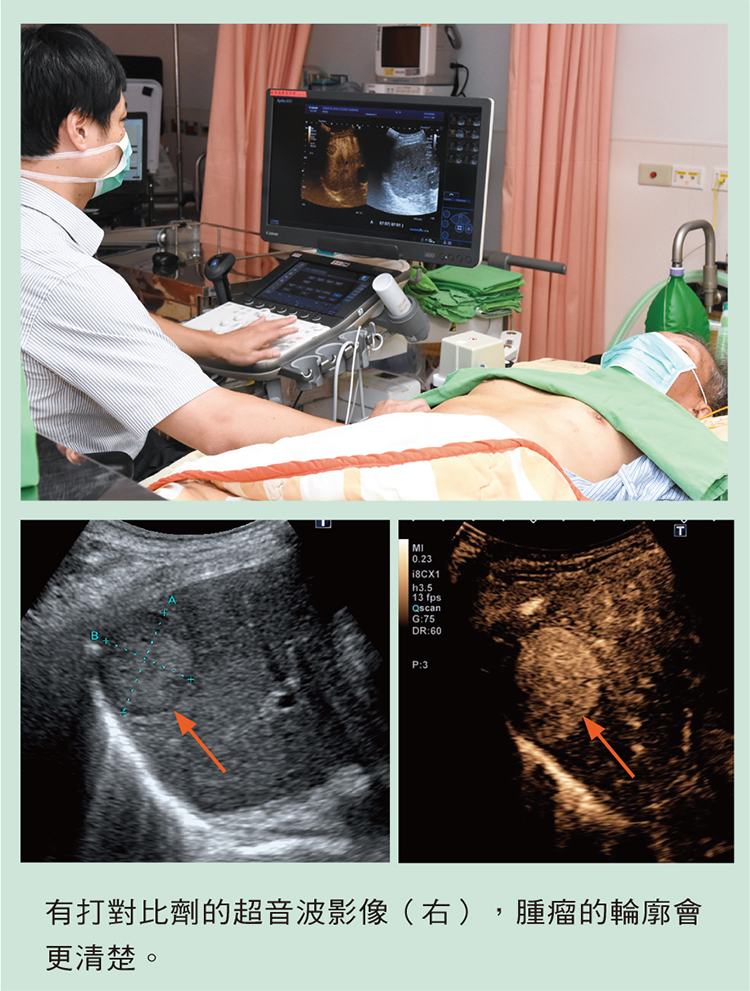
《圖說:有打對比劑的超音波影像(右),腫瘤的輪廓會更清楚。》
準確度與CT、MRI相近
對比劑超音波檢查在國外已行有年,根據歐美國家研究發現,對比劑超音波檢查的準確度與MRI及CT相近,而且病人檢查時間縮短,便利性高。也有大腸癌發生肝轉移病人,利用CT找到2顆腫瘤,用對比劑超音波還能發現更小的腫瘤,顯見其診斷效果良好。
準確度與CT、MRI相近
對比劑超音波檢查在國外已行有年,根據歐美國家研究發現,對比劑超音波檢查的準確度與MRI及CT相近,而且病人檢查時間縮短,便利性高。也有大腸癌發生肝轉移病人,利用CT找到2顆腫瘤,用對比劑超音波還能發現更小的腫瘤,顯見其診斷效果良好。
國內目前已有醫院提供這項檢測,可做為原發性與轉移性肝癌篩檢,更清楚分辨良性與惡性肝腫瘤,亦可用於診斷與治療,增加射頻消融治療定位的正確性,以及肝癌治療後追蹤,讓患者多一項檢查選擇。
對蛋過敏者不適用
整體而言,超音波的對比劑比起CT或MRI顯影劑安全得多,不需經過腎臟代謝,不具腎毒性,適用於腎功能不良、無法注射顯影劑電腦斷層攝影或磁振掃描的病患,檢查前不必進行腎功能的血液測試。
超音波對比劑屬於微氣泡,經由呼吸就能代謝出去,不過有嚴重肺疾的病人,對比劑通過肺部作為主要代謝及排泄,可能使肺功能降低的症狀加重,應由醫師評估合不合適。
另外,因為對比劑中含有蛋衍生成份(氫化蛋磷脂?絲氨酸鈉,H-EPSNa),對於雞蛋或蛋製品過敏的患者,可能會引起過敏反應,也不適合接受這項檢查。
要注意的是,超音波對比劑雖然安全性高、副作用小,不過也有一些注射後腹瀉、頭痛、蛋白尿、口乾、注射部位不適等副作用的案例,因此在施行檢查前,病人仍須了解相關細節與可能發生的副作用。
該項檢查健保尚不給付,病人可視自身的經濟及病況,與醫師討論是否自費檢查。
請別錯過本期其他精彩內容…
- 總編輯的話/迎向下一個四分之一世紀
- 看新聞學保肝/600萬國人 估有脂肪肝!
- 看新聞學保肝/國內首例 B肝孕婦換肝成功 保住小生命
- 特別企劃/戰勝肝病 感謝有您!廖運範院士、陳定信院士專訪
- 熱門話題/王彩樺C肝「畢業」喜極而泣 健保署預算加碼 盼C肝治療不中斷
- 醫學新知/改造T細胞受體 治療肝癌病人有望?!
- 肝病診療室/慢性B肝患者停藥抉擇, 問題一次釐清!
- 肝病診療室/保護兒童,從小遠離A、B、C肝!
- 愛肝新樂園/洗心革面顧健康
- 生活醫館/壺腹癌病例有增加趨勢 該如何治療?
- 生活醫館/超音波發現膽結石,要拿掉嗎?
- 肝爹信箱/肝爹信箱 有問必答
- 活動繽紛/肝基會25週年「感恩國人用愛消滅國病!」
- 醫療行腳/扶輪傳愛 消除C肝 政愛社領軍 台北孔廟篩檢1475位民眾
- 請問好心肝/心臟血管科5問 許寬立教授 專業解答.
- 請問好心肝/皮膚科5問 王莉芳醫師 專業解答
- 請問好心肝/神經內科2問 廖晉緯醫師 專業解答
- 請問好心肝/復健科4問 許承嵐醫師 專業解答
- 請問好心肝/新陳代謝內分泌科3問 陳思潔醫師 專業解答
- 好心肝故事/小提琴家林孟穎 健檢驚見18公分血管瘤
- 支持好心肝/好心肝門診中心將擴充樓層及診間 籲請各界熱烈愛心襄助