
第89期
出刊日:2020-01-15
返回上一層液態切片研究正夯 抽血驗肝癌有譜?
近來,希望利用抽取血液或體液,就能檢查出癌症──所謂液態切片(Liquid Biopsy)的研究如雨後春筍,而在肝癌的應用上也有一些進展。不過,目前國內外的研究進度,要達到利用液態切片就能篩檢「早期」肝癌的目標,尚有很長一段路要走;用於肝癌病人是否復發的追蹤,則有機會較早實現!
諮詢/陳培哲(中研院院士、臺大醫院內科部暨醫學研究部主治醫師、臺大醫學院臨床醫學研究所教授)
撰稿/張雅雯
肝癌雖然已非國人十大癌症死亡排行榜首位,仍是第二名殺手。初期症狀不明顯、很難早期發現、早期治療,以及高復發率,都是肝癌死亡率仍舊居高不下的主要原因,所以醫界也在尋求是否有更好的方式可以早期發現肝癌。
腹部超音波判定因人而異
胎兒蛋白用於篩檢不夠精準
現行肝癌早期診斷的主要工具有兩種:一是腹部超音波,可檢查出3公分以內的早期肝癌,甚至1公分的腫瘤也有機會看得到,但已經是極限;然而這個檢查需耗費大量醫師人力,且容易受到操作者的經驗影響,導致檢查結果可能有差異,無法達到大規模篩檢的效益。
另一個工具就是抽血檢驗甲型胎兒蛋白(AFP),這種測定法很標準化,結果不會因人而異,但並非所有肝癌病人的甲型胎兒蛋白數值都會升高,早期肝癌更少升高,所以不能單靠此一數值來篩檢,臨床上多用於肝癌病人的術後追蹤,觀察是否復發。
因此,腹部超音波與甲型胎兒蛋白,都不算夠好的早期肝癌篩檢工具,即使對肝硬化這種高風險族群,每6個月甚至3個月做一次,仍有少數漏網之魚。
那麼,除了甲型胎兒蛋白以外,是否有其他生物標記,也可以篩檢出肝癌?的確有,日本透過抽血的方式,檢測了另外兩個肝癌腫瘤標記:異常凝血酶原(PIVKA-Ⅱ)以及胎兒蛋白的L3亞型,但大規模臨床研究發現,這兩種標記對篩檢出肝癌的效益增加有限,所以國內及歐美運用並不普遍。
ctDNA又稱癌症DNA指紋
開啟液態切片研究熱潮
目前主要的腫瘤標記大都是看腫瘤釋放出來的蛋白質,但因為這些蛋白質在正常細胞和腫瘤細胞都有,只是腫瘤細胞含量較多,就像肝癌的標記甲型胎兒蛋白在正常細胞也有,所以其實很難作為揪出肝癌的單一指標。
也因此,醫界近年來致力於研究「循環腫瘤DNA(circulating tumor DNA, ctDNA)」,又稱為腫瘤的DNA指紋。這是由腫瘤細胞染色體釋放到血漿中的DNA,攜帶有與原發腫瘤一致的分子遺傳學訊息。
進一步來說,正常細胞會變成腫瘤細胞,是因為基因突變一直累積的結果,所以正常細胞與腫瘤細胞最大的差別,就是這些突變的基因。腫瘤細胞會生長也會壞死,當它壞死時,腫瘤細胞的DNA就會釋放到血液中,所以,學理上來說,若能找到腫瘤細胞DNA特有的突變,就能用來區分正常細胞及癌細胞。
此類研究主要有幾個方向:
一是檢測ctDNA核苷酸的突變。ctDNA可反映腫瘤組織中的基因突變圖譜,也就是看它核苷酸序列的改變,比如有個核苷酸被其他取代?或是多了一個、少了一個核苷酸的變異。
二是檢測腫瘤細胞DNA的甲基化。若ctDNA核苷酸沒有突變、但是受到修飾,這屬於染色體表觀(epigenetics)的變化,例如甲基化。也就是從腫瘤釋放出的DNA,去看它甲基化的形式,是不是可當作癌症的指標。
抽血亦可檢測腫瘤釋放出的RNA
唯現階段只能定量
還有的研究是檢測腫瘤也會釋放到血液中的核糖核酸(RNA)。過去認為RNA比較不穩定、不太容易測定,現在已知有些微小的RNA(microRNA)可以保留比較久,所以也有人從檢測是否有腫瘤釋放出來的microRNA著手;有些RNA是包在細胞膜裡面,叫做外泌子(exosome),均可作為檢測目標。
例如日本有家公司近期也宣稱運用microRNA技術可以「一滴血檢驗13種癌症」,病人抽血後經過晶片檢測等步驟,若發現癌細胞特有的microRNA分泌量(濃度)增加,就能發現癌症。
這是一種「定量檢測」,不像循環腫瘤DNA檢測有明確的指標(檢測腫瘤特有的基因突變),所以萬一檢查出microRNA分泌量增加,也只知道可能有癌症,但不知道癌症在哪裡。根據報導,該技術現階段只能檢測出驗血者罹患了13種癌症中的至少一種,還無法確定是其中哪幾種。
該公司預計2020年以癌症患者為對象進行實證試驗,所以此技術是否真能用於臨床,還有待試驗結果出爐。
美國FDA授予突破性醫療器械認定
鼓勵投入ctDNA的臨床試驗
透過液態切片開發癌症早期篩檢的技術,最早在美國興起,陸續有些生物科技公司的產品研究獲得美國FDA授予「突破性醫療器械認定」,進而展開臨床試驗。比如有公司挑了20、30個基因,去比對腫瘤細胞與正常細胞的甲基化分布位置,嘗試鑑別出不同癌症的甲基化模式。
有的公司則運用NGS次世代定序來看ctDNA的核苷酸序列有沒有突變,這是大規模並平行地連續鑑定小片段DNA的基礎,知悉腫瘤突變資訊,可以預測臨床預後,並引導腫瘤演變的治療方向。
液態切片目前敏感度有限
仍無法用於早期癌症篩檢
然而,在看似一片欣欣向榮的研究背後,仍有許多困難亟待克服。首先,血液中的循環DNA(circulating DNA)裡面大多是正常體細胞壞死而來,腫瘤ctDNA在血液中的含量極微,並且混雜在更大量的正常游離DNA背景中,目前上述液態切片技術需腫瘤ctDNA佔所有循環DNA的百分之一到千分之一才能偵測出來。
舉例而言,以一個體重100公斤的人來說,腫瘤要一公斤(約10公分大),ctDNA才占到循環DNA的百分之一時才能診斷;算起來那可是一個很大的腫瘤,超音波早就可以看出來了。若液態切片可以做到千分之一,那技術已經很厲害,但腫瘤也要大約是100公克,換算起來腫瘤約3~4公分,也已超過早期大小。如果腫瘤這麼大才能透過液態切片檢驗出來,就無法達到早期篩檢的理想。
也就是說,液態切片若要達到早期篩檢的目的,必須要能做到ctDNA佔所有循環DNA的「萬分之一」的敏感度,這非常困難,也是現在ctDNA還無法用於早期篩檢癌症的最大癥結。
現在液態切片比較確定可運用於臨床的,就是追蹤中晚期癌症治療成效及是否復發。
臺大醫院打造
B肝肝癌術後復發追蹤檢測平台
肝癌是復發率很高的癌症,一般肝癌患者手術後1年,約3成會復發,因為手術只能切除看得到的腫瘤,但有些看不到的腫瘤細胞可能已經擴散出去,所以,ctDNA在肝癌病人手術後追蹤的應用,就是從其切除的腫瘤中找出其特有的基因突變,再檢測術後病患血液中還有沒有原來腫瘤的ctDNA,若有,表示還有腫瘤細胞存在,可能再復發。
這對於B型肝炎引起的肝癌特別有用,因為90%以上B肝病毒的DNA會嵌合到染色體裡面去,可以找B肝病毒跟人類染色體嵌合的片段(chimera DNA),這個病毒嵌合DNA可作為這一肝癌獨特的癌症DNA指紋。用這個嵌合的片段去設計一個獨有的ddPCR(droplet digital PCR),可以偵測釋放到血液中特有的ctDNA生物標記。ddPCR的優勢是目前最敏感的方法,可以測到佔所有循環DNA的「萬分之一」的ctDNA。
臺灣大學此項研究已經申請專利,並且於2016年技術轉移業界,打造國內「B肝肝癌術後復發追蹤檢測平台」。在先導臨床試驗中,收集了臺大醫院50名肝癌病患,在他們術後兩個月去檢驗血漿中是否殘留有跟腫瘤同樣突變的ctDNA,若有,1年再發率高達90%。接下來臺大、台北榮總、三總、林口長庚四大醫學中心,要進行更大規模的臨床試驗。
針對每一顆腫瘤「客製化」
每個病人的肝癌突變基因都不盡相同,即使是同一個病患,若幾年後再長出肝腫瘤,或肝臟長出不只一顆腫瘤,這些腫瘤的突變基因也可能不一樣。所以在檢測前,要看這幾顆腫瘤裡面B肝病毒跟人類染色體連接的片段的突變,是否都一樣,若不一樣,就要分別做ddPCR。也就是說,ddPCR這個方式不僅得針對每個肝癌病人,還得對每個病人的每一顆肝腫瘤予以「客製化」。
這個ddPCR檢驗方式目前適用於90% B肝病毒引起的肝癌,至於C肝病毒引起的肝癌,可用的ddPCR只適用於50%的病人。
這個技術平台預計未來還可以擴及做子宮頸癌篩檢,因為導致子宮頸癌最主要的HPV病毒,同樣會跑到染色體,現在用細胞學去檢測較耗費人力,若能去找有嵌入HPV病毒的DNA,就可以標準化檢測。
液態切片用於肝癌術後追蹤
盼更早得知復發情形
可以預期的是,使用液態切片可以更方便追蹤肝癌病人手術後的治療效果,以及早點得知是否復發,再給予因應的治療策略。比如透過液態切片發現仍有殘餘癌細胞,若在影像檢查下已經可以發現腫瘤,就給予相對應的治療(開刀或電燒等);若還看不到腫瘤在哪裡,未來也許可以考慮使用PD-1等免疫療法,而不是等到肝腫瘤真的長出來了再治療,可能為時已晚。不過,這些必須等更大規模的臨床試驗結果出爐,才能真正應用在臨床上。
此外,此類技術若可行,讓病人能早點使用仍要符合法規,最近衛生福利部醫事司正研擬要把實驗室開發檢測(laboratory developed test, LDT)納入「特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法(簡稱特管辦法)」,串連產官學研界攜手投入,讓新開發的癌症檢驗技術納入特管範圍,以早日造福病人。
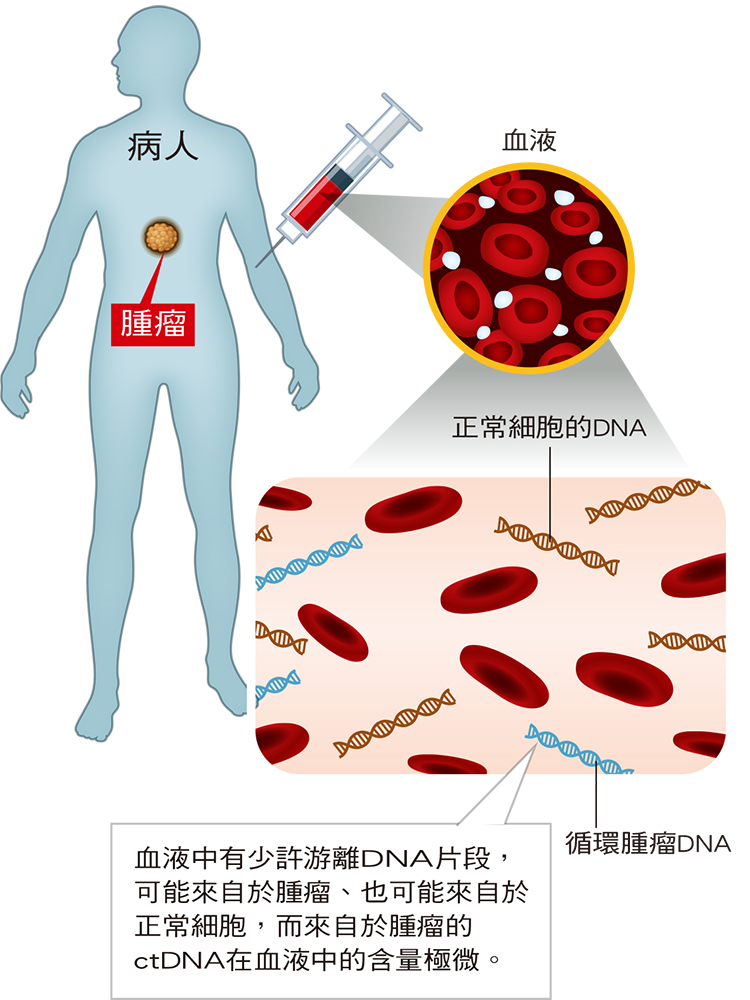
(圖說:抽血檢驗循環腫瘤DNA原理)
體內若有腫瘤,腫瘤細胞會釋放DNA到血液中,稱為循環腫瘤DNA(circulating tumor DNA,ctDNA),可做為腫瘤的基因指紋,因此可透過抽血檢驗是否有該腫瘤存在。
cfDNA和ctDNA是什麼?
當體內細胞凋亡或壞死,其中的DNA會釋放出來,隨著血液或體液循環,cfDNA(cell-free DNA)就是存在血液中游離的DNA片段,可能來自於腫瘤、也可能來自於正常細胞。而來自於腫瘤的稱作ctDNA(circulating tumor DNA),屬於高敏感性、高特異性的腫瘤標記物,相當於腫瘤細胞釋放到血液中的「身份指紋」,醫界認為這個腫瘤標記物可提供DNA核苷酸突變、表觀遺傳改變和其他形式的腫瘤特異性異常訊息。
液態切片vs組織切片
由於早期診斷肝癌的工具仍有改善空間,所以近年來有不少專家將肝癌的早期篩檢寄望於液態切片。與傳統組織切片比較,傳統組織切片看似準確仍有缺點,一是需透過開刀或用細針穿刺等侵入性方式才能取得腫瘤細胞;而且用在肝癌,也僅限於腫瘤長在肝臟的某些位置才有辦法執行。此外,腫瘤是很多細胞不斷增殖的結果,具異質性、每個細胞長得不太一樣,切片只能看到抽樣的那一部分,其實也無法涵蓋全部的腫瘤細胞。
由於腫瘤所有細胞的DNA都有可能釋放到血液中,因此液態切片幾乎可以「一網打盡」,等於是全部取樣,理論上會比切片更有代表性,這是最大的優點。此外,由於液態切片僅靠抽血,可反覆進行,還能反應腫瘤的整體情況,克服了組織切片的侷限性,理論上更適合用於用藥選擇、追蹤治療效果或了解抗藥性。
然而,液態切片目前若要用於篩檢包括肝癌在內的癌症,敏感度仍不夠高,這是最大的困境,也是亟待突破之處。
請別錯過本期其他精彩內容…
- 總編輯的話/一滴血驗肝癌?再等等!
- 健檢機構創辦人李文雄 胰臟癌病逝
- 體溫飆高引發猛爆性肝炎? 醫師:少見但有可能
- 預防胃癌 根除幽門螺旋桿菌奏效! 台灣領先全球制訂除菌指引
- 晚期肝癌用藥新突破 免疫加標靶 有望成為一線療法
- 肝硬化病人 多肌肉 少昏迷!
- 驗到C肝病毒即可治療! C肝治癒後如何追蹤?
- 怎麼看自己的 肝臟抽血報告? 《GOT、GPT、AFP篇》
- 愛肝新樂園/保養維修 才能長治久安
- 內視鏡檢查發現黏膜下腫瘤!怎麼辦?
- 器官「漏餡」了? 疝氣修補讓器官乖乖歸位
- 腸胃不適 也可能是維他命B12缺乏?!
- 肝爹信箱 有問必答
- 許金川教授榮獲吳尊賢愛心獎 獎金百萬捐作醫學研究
- 肝基會成立的推手 ── 連文彬教授
- 免費肝病篩檢列車 開往屏東東隆宮 保庇鄉親好心肝!
- 救救肝苦人 感謝您的支持 2020年持續鎖定C肝高盛行地區 力拼治療率百分百
- 請問好心肝/腎臟疾病4問 吳寬墩教授 專業解答
- 請問好心肝/消脂保肝5問 粘曉菁醫師 專業解答
- 請問好心肝/嗓音保健4問 王棨德醫師 專業解答
- 請問好心肝/手麻腳麻4問 廖晉緯醫師 專業解答
- 請問好心肝/甲狀腺功能亢進5問 陳思潔醫師 專業解答
- 好心肝故事/黃雪美女士 健檢初體驗 頓悟生命價值