
第85期
出刊日:2019-01-15
返回上一層B肝根治有望嗎?藥物積極研發中
國內約有200多萬名B型肝炎帶原者,治癒B肝是所有患者的夢想,醫學界也正如火如荼針對B肝病毒進行新藥研發,希望能找出「弱點」一舉攻克!目前已有多種藥物進入第二期臨床試驗,未來5年、10年,或許有機會上市,值得期待。
諮詢╱楊宏志(臺大醫院內科部胃腸肝膽科主治醫師、臺大醫學院微生物學科副教授)
撰稿╱黃筱珮
B肝與C肝都是「國病」,C肝全口服新藥可帶來99%的高治癒率,讓B肝患者羨慕不已,因為目前除了事先打疫苗可預防B肝外,一旦成為B肝帶原者,基本上只能抑制B肝病毒複製,無法根除B肝病毒。
B肝病毒難纏
究其根本,B肝是DNA(去氧核醣核酸)病毒,C肝是RNA(核糖核酸)病毒,RNA病毒的特性是只要用藥物壓制一段時間,多半就會自行消失;DNA病毒就難纏得多,B肝病毒與HIV(愛滋)病毒(附註: HIV雖然是RNA病毒,但是感染細胞後,RNA會被轉成DNA鑲嵌到宿主染色體中)都屬於這類病毒,一旦感染到,病毒就會躲在體內伺機而動。
雖然B肝病毒基因體很小,只有3000多個核苷酸,在目前已知的人類的DNA病毒屬於非常小的一種,不過,對付起來仍然困難重重。
停藥後可能復發
現在治療B肝主要有兩類藥物,一是「口服抗病毒藥物」,屬核苷酸類似物,作用在於抑制病毒的複製,每天吃一顆;另一種是「長效型干擾素」,是具有多種功能的活性蛋白質,有壓制病毒複製、抗病毒的效果,也有提升免疫力功效,一週打一次即可。
口服抗病毒藥物方便、服藥順從性高,絕大多數病人在規律服藥的情況之下,都可以達到在血液中檢測不到病毒的結果;但即便如此,肝臟裡面還會躲藏著具有複製能力的B肝病毒共價閉合環狀DNA(cccDNA),一旦停藥後,病毒有9成的機會再開始旺盛複製,有一半的患者必須再吃藥壓制。
臨床上曾有病人口服抗病毒藥物超過10年,服藥期間血中測不到病毒,一停藥仍復發,相當頭痛。
而長效型干擾素的缺點是副作用較大,特別是開始治療的前1至2個月最明顯,患者可能出現掉髮、發燒、嘴破等不適症狀,有約一成到一成五的病人會有嚴重副作用,且多數病人不愛打針,所以接受度較低。不同於口服藥治療期間往往很長,干擾素治療期間固定(一年),且達到B肝表面抗原消失的比例較口服抗病毒藥物高,可達5%,口服藥大約只有1%。醫界一般建議,如果身體狀況許可,可以先採用干擾素治療,不只治療期間固定,且能一拚較高的表面抗原消失機率。
完全治癒是B肝新藥研發的終極目標
不論採行何種治療,目前能夠達到「功能性治癒」的比例仍偏低,更別說達到「完全治癒」。所謂的「功能性治癒」是指B肝表面抗原消失、抗體出現,但肝臟內還存有具複製能力的cccDNA;而「完全治癒」指的是不僅表面抗原消失、抗體出現、並一舉殲滅體內所有具有複製能力的cccDNA並除去鑲嵌在宿主染色體的B型肝炎病毒基因體片段。所謂的「完全治癒」堪稱是醫學界追求的「聖杯」,但以目前醫療技術而言非常困難,所以現今B肝新藥努力研發的方向是退而求其次希望能達到「功能性治癒」的目標。
cccDNA是B肝病毒複製的「模板」,即使以現行藥物治療後,B肝表面抗原已消失,但cccDNA仍然會躲在受感染的肝細胞裡面,一旦患者因病情需要接受很強的免疫抑制劑或化學治療時,例如淋巴癌患者接受化療及莫須瘤(rituximab)治療時,因免疫系統受到嚴重壓制,約有1成至1成5的患者B肝會復發,甚至出現猛爆型肝炎。
也就是說,即使已達到「功能性治癒」的B肝患者,雖然血液檢驗看起來已不是帶原者,但是當其免疫力被強力抑制時,藏在肝內的cccDNA很容易再度活化,讓B肝病毒又被製造出來,所以必須小心預防。
未來,若有新藥問世能夠解決cccDNA的問題,代表能把體內B肝病毒清光光,不管什麼情況病毒都不會再出現,這就是B肝治療的「終極目標」,也是醫師和患者的期待。
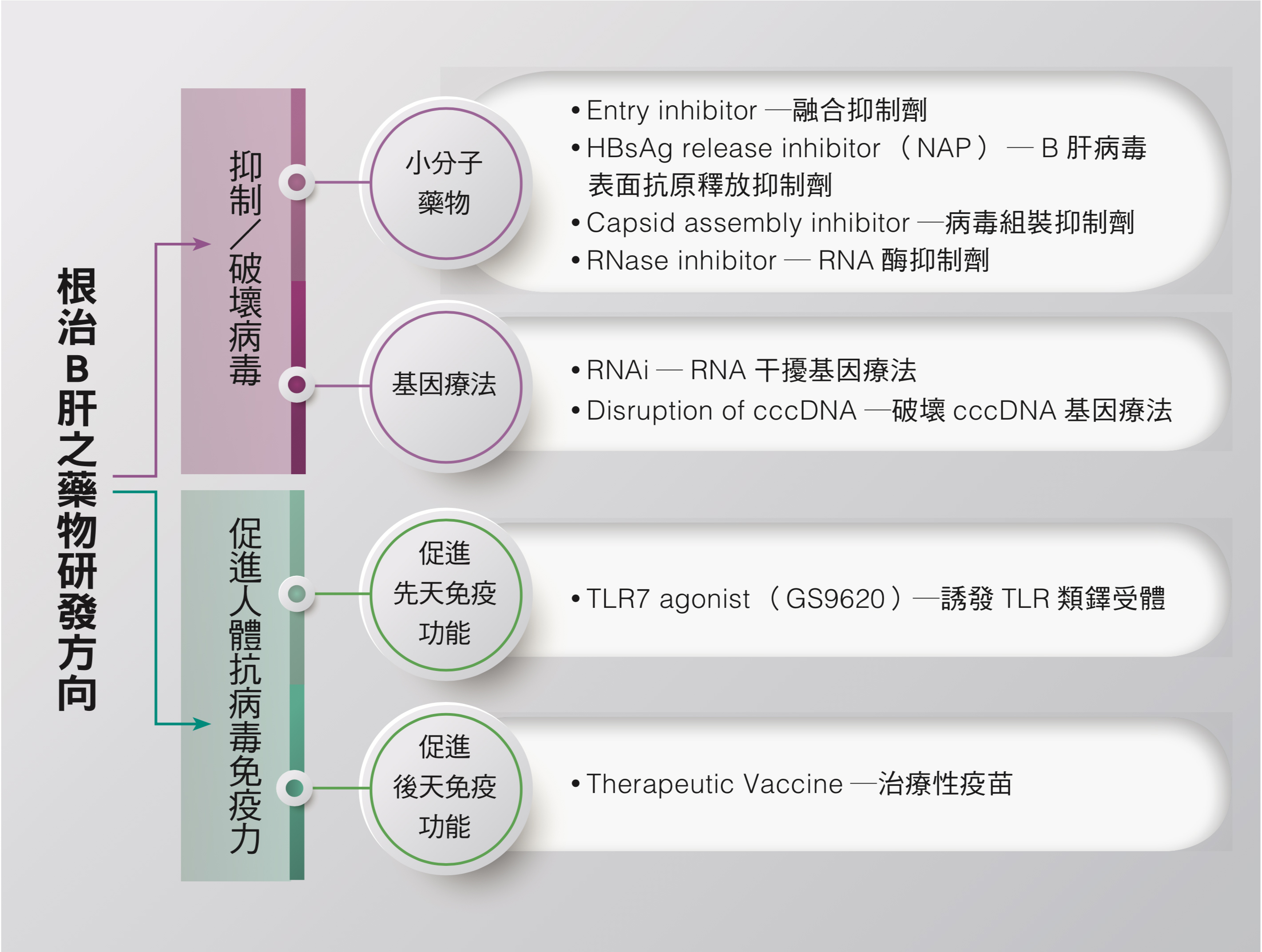
B肝新藥研發朝兩大方向
B肝新藥的研發百家爭鳴,不過治療的機轉主要分為兩方面,一是抑制或破壞病毒,使病毒不能複製,自動消減;二是促進人體抗病毒的免疫力,達到清除病毒的效果。
一、 抑制或破壞病毒
在抑制或破壞病毒的研發方面,著重於發展小分子藥物或基因治療藥物,阻斷病毒複製,或抑制病毒蛋白的製造,有效壓制病毒量,如此一來有機會喚醒身體免疫大軍,達到更好的病毒清除效果,並且期待直接破壞cccDNA,達到根治結果。
小分子藥物以B肝病毒表面抗原釋放抑制劑「HBsAg release inhibitor」中的核酸聚合物(nucleic acid polymer, NAP)的初步效果最令人驚艷。根據藥廠發布的小規模臨床試驗結果,發現NAP藥物能夠有效抑制B肝病毒表面抗原從細胞內釋放,若再搭配干擾素或口服抗病毒藥物,更可有效使表面抗原陰轉,成功率比其它藥物高很多,甚至停藥1年之後仍有效,這是目前醫學界高度關注的一款新藥,當然還有待更大規模試驗去驗證。
若更大規模的人體試驗證實NAP確實能在停藥後持續維持患者表面抗原陰性的結果,將是一款「明日之星」的新藥,解決現在患者一停藥就有高比例復發的困境。
另一類藥物RNAi也備受注目。RNAi屬於「基因靜默療法」,製造20個核苷酸序列的小片段RNA,和B肝病毒製造蛋白的RNA 結合,藉此干擾並且破壞病毒的基因表現,達到抑制B肝表面抗原的作用,但是現在遇到的臨床試驗困境是,一旦停藥很容易又復發。
RNAi的藥物機轉與「CRISPR/Cas9基因編輯技術」作法雷同,都屬於基因治療,差異則在於RNAi作用於RNA,CRISPR則是作用在DNA。
臺大醫學院也開創先河,曾經嘗試運用CRISPR基因編輯於B肝治療的實驗,不過實驗結果發現,CRISPR雖可有效破壞B肝病毒DNA,卻也可能切到其它細胞的DNA的風險,安全性有待再觀察。無論如何,基因編輯是劃時代的發現,未來應會陸續突破。
二、 促進人體抗病毒免疫力
B肝新藥還有另一大類機轉,即透過促進人體自體免疫功能,與B肝病毒對抗。人體免疫力可分先天免疫力(Innate immunity),以及後天免疫力(Adaptive immunity),先天免疫力扮演第一線防疫的角色,一旦病毒或細菌入侵時,人體會發燒產生干擾素,大量製造白血球進行攻擊,不僅對於清除病原菌很重要,對於發展抗原專一性的後天免疫也很重要。
不過B肝病毒很聰明,就像是「偷偷摸摸的病毒」,可以避開免疫系統的偵側,因此需要一些機制加以誘發。
受到注目、由Gilead藥廠研發的TLR7 agonist (GS9620)新藥,就屬於這類刺激先天免疫系統的藥物,藉由誘發類鐸受體「toll-like receptor, TLR」的機轉,進一步誘發抗病毒免疫作用,去清除B肝病毒感染之細胞,達到治療B肝的效果。
而在後線防護角色的後天免疫系統中,T細胞和B細胞扮演重要角色,具有專一性,能夠精準攻擊外來「異物」,加以消滅,並配備免疫記憶,未來再遇到相同病毒或細菌抗原時,可以迅速產生免疫反應加以對抗。
醫學界也在研發「治療性疫苗(therapeutic vaccine)」,期待誘發更強的後天免疫細胞去攻擊B肝病毒,這與癌症治療的免疫療法有同工異曲之妙。
B肝治療的新藥研發已有初步結果,多款新藥已經走出實驗室、進入第二期人體臨床試驗,雖然有效性和安全性必須再反覆確認,還有一段路要走,不過距離上市已非遙不可及,為患者帶來治療的新希望。
請別錯過本期其他精彩內容…
- 總編輯的話:新年展新局 消滅肝病再升級
- 胰臟癌 早期難發現6成患者診斷已是第4期
- 「武功高強」惜難敵肝癌武俠小說大師金庸病逝
- 中、晚期肝癌新戰場新療法輩出 點燃病人希望
- 質子治療殺肝癌 2年存活率約7成
- 健保給付全口服新藥不設限根除C肝可望提早達標
- 同時有B肝和C肝,如何治療較好?
- B肝病毒量爆表,應該趕快用藥嗎?
- 性傳染病比你想得還要多!肝炎與愛滋有共病風險
- 肝癌,開刀?不開刀?
- 胃有點破皮,是怎麼了?
- 胃悶痛、消化不良…當心萎縮性胃炎!
- 罹患大腸直腸癌,一定要做人工肛門嗎?
- 肝爹信箱 有問必答
- 跑出健康 公益愛延續!
- 肝臟健康「照」得住!新北市勞工首次大規模「腹部超音波肝癌大篩檢」
- 2019年「救救肝苦人」再升級
- 【請問好心肝】腸胃科5問邱世賢醫師 專業解答
- 【請問好心肝】 身心科4問胡海國教授 專業解答
- 【請問好心肝】 胸腔科7問李麗娜教授 專業解答
- 【請問好心肝】 內分泌暨新陳代謝科5問黃天祥教授 專業解答
- 【請問好心肝】 泌尿科4問周淇業醫師 專業解答
- 【好心肝故事】 先生肝炎驟逝 捐款支持擴建郭玲慧:好心肝,好用心
- 【好心肝故事】 健檢才知眼中風藍秋桂:好心肝助我重見色彩